吴晓菲 孙 琼 周芳芳 蒋 林
多发性骨髓瘤(multiple myeloma, MM)是恶性浆细胞克隆性疾病,其分泌的单克隆球蛋白引起全身性损害,以骨质破坏、肾功能不全、贫血、高钙血症等为临床表现[1]。MM患者中可观察到一系列T淋巴细胞数量、分化和功能异常。Th17和Th22是新的CD4+T淋巴细胞亚群,在MM的疾病进展中发挥重要作用。Prabhala等[2]研究发现,MM患者外周血及骨髓单个核细胞中白细胞介素-17A(interleukin-17A,IL-17A)、IL-22和辅助性T细胞17(T helper cell 17, Th17)水平明显高于健康人,促进体外和体内的骨髓瘤细胞生长,以及增强骨髓瘤细胞对骨髓间充质干细胞的黏附性,同时IL-17和IL-22联合抑制健康供者外周血单个核细胞中Th1细胞因子的产生,削弱免疫反应[3]。最重要的是,Th17可通过CCL20-CCR6轴被募集到炎症部位,IL-17上调核转录因子-κB(nuclear factor kappa B, NF-κB)配体受体激活因子(receptor activator of NF-κB ligand, RANKL)的表达,后者促进破骨细胞形成;
临床上也同样观察到有溶骨性病变和非溶骨性病变患者中Th17细胞和IL-17的差异[4,5]。Th22细胞分泌的IL-22与肿瘤细胞上的IL-22受体结合,诱导信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,促进MM细胞的生长和耐药性,IL-13通过促进骨髓间充质干细胞黏附分子和IL-6表达,间接增强MM细胞和间质细胞的黏附,调节MM肿瘤细胞的增殖和耐药;
临床上也观察到Th22细胞与分期呈正相关,并在患者获得缓解后减少的现象[6]。
慢性炎症刺激和肿瘤微环境影响下,大量T淋巴细胞受体激活诱导干扰素调节因子4(interferon regulatory factor 4, IRF4)、B淋巴细胞转录激活因子(B cell activating transcription factor, BATF)和活化T淋巴细胞核因子c1(nuclear factor of activated T cells c1, NFATc1)驱动T淋巴细胞耗竭。耗竭的T淋巴细胞表现为线粒体功能障碍,代谢活性降低,产生细胞因子能力明显减弱,包括γ-干扰素 (interferon-γ, IFN-γ)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、IL-2等,并表达抑制性受体,包括程序性死亡受体-1(programmed cell death-1, PD-1)、淋巴细胞激活基因-3 (lymphocyte activation gene-3, LAG-3)、T淋巴细胞免疫球蛋白黏蛋白-3(T cell immunoglobulin and mucin domain-3, TIM-3)、细胞毒性T淋巴细胞相关蛋白-4(cytotoxic T-lymphocyte-associated protein 4, CTLA-4)、T淋巴细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains, TIGIT)和CD244等,最终抗原特异性T细胞缺失,出现肿瘤逃逸[7]。
缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)是α亚基(通常为HIF-1α或HIF-2α)与β亚基(HIF-1β,也称为芳基烃受体核转位蛋白)一起组成。在缺氧条件下,HIF-1α不被蛋白酶体降解,被转运到核内与HIF-1β形成二聚体,与缺氧反应元件结合,激活下游多种基因转录,发挥重要的生物学作用。在缺氧条件下,HIF-1α结合的某个缺氧反应元件(hypoxia-responsive element, HRE)在Th17转录因子视黄酸受体相关孤儿受体-γt(orphan nuclear receptor ROR gammaT, RORγt)的近端,诱导Th17分化,并促进Treg转录因子叉头框p3(forkhead box protein 3, Foxp3)蛋白降解,通过以上机制上调自身免疫性脑膜炎模型中Th17/Treg比值,介导疾病进展[8]。另一方面,在肠道炎症相关研究中发现HIF-1α与IL-22的启动子结合,促进Th22转录因子芳香烃受体(Ah receptor nuclear translocator protein, AhR)表达,Th22分化和IL-22产生[9]。然而,关于MM中HIF-1α的表达,及其与T淋巴细胞分化相关性的研究较少。
本研究利用MM患者的骨髓活检切片标本并通过免疫组化技术检测HIF-1α在MM中的表达水平,并通过流式细胞术检测Treg、Th17和Th22细胞分化水平,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction, RT-qPCR)检测T淋巴细胞中T淋巴细胞耗竭相关基因表达,分析患者临床特征、HIF-1α表达水平、T淋巴细胞分化特征之间的相关性,旨在为深入研究MM免疫逃逸提供新的视角和更多的实验证据。
1.材料与仪器:抗CD4-FITC、抗Foxp3-PE、抗CD25-APC、抗IL-17A-PE、抗IL-22-PE均购自美国eBioscience公司;
兔抗人HIF-1α抗体购自武汉Bioswamp公司;
MaxVision TM HRP-Polymer anti-Mouse/Rabbit IHC试剂盒购自福州迈新生物技术开发有限公司。固定破核剂购自美国BD公司;
SYBR快速qPCR试剂盒购自巴塞罗那Biosystems公司;
Oligo (dT)18 Primer TaKaRa 3806、PrimeScript Ⅱ RTase、Recombinant Rnase Inhibitor均购自日本TaKaRa公司;
10mmol/L脱氧核糖核苷三磷酸预混液购自北京索莱宝科技有限公司;
人全血单个核细胞分离液购自天津TBD公司。仪器:GE48527型PCR仪购自杭州柏恒科技有限公司;
CFX-Connect 96型实时荧光PCR仪购自美国伯乐公司;
NovoCyte型流式细胞仪购自美国艾森公司。
2.研究对象:收集2021年1月~2022年2月华中科技大学同济医学院附属武汉市中心医院收治的9例MM患者和3例缺铁性贫血(iron deficiency anemia, IDA)患者的病例资料,分别纳入MM组和IDA组。所入选MM患者均符合《中国多发性骨髓瘤诊治指南》诊断标准,IDA患者均符合缺铁性贫血专家共识标准,并排除合并肿瘤的患者[10,11]。本项目通过华中科技大学同济医学院附属武汉市中心医院医学伦理学委员会审批[伦理审批号:院-市卫健委-伦2021(16);
WHZXKYL2022-006],参与患者均签署知情同意书。MM组患者中,男性5例,女性4例,患者中位年龄为69(55,81)岁,发病年龄高峰为65~75岁,IDA组患者中,女性2例,男性1例,患者中位年龄为36(33,74)岁。疾病分型:IgG型6例,IgA型2例,轻链型1例。按照国际分期系统(International Staging Systyem, ISS)进行疾病分期,Ⅰ期3例,Ⅱ期2例,Ⅲ期4例;
按照DS分期(Durie-Salmon, DS)进行疾病分期,ⅡA期3例,ⅢA期4例,ⅢB期2例。结合MM患者初诊时头颅、骨盆X线片、以及胸腰椎CT统计每位患者直径≥5mm独立溶骨性骨质破坏的部位数量,详见表1。
3.免疫组化方法:应用Maxvision法对两组患者骨髓病理进行HIF-1α免疫标记,DAB显色,苏木精复染,通过显微镜拍照,Leica Application Suite图象系统采集样本相关部位。苏木精染细胞核为蓝色,DAB显出阳性为棕黄色。
4.流式细胞术:(1)Treg:取各组外周血样本,1×106个细胞,100μl 磷酸盐缓冲液(phosphate buffered saline,PBS)重悬后,每管加入5μl CD4和CD25抗体,4℃避光孵育30min。洗涤后每管加入固定剂1ml,重悬细胞,避光孵育20min离心后每管加入破膜剂1ml,重悬细胞,避光孵10min后,离心重悬细胞,每管加入5μl的Foxp3抗体,4℃避光孵育45min。400μl的PBS重悬细胞,4℃避光保存,上机检测。(2)Th17、Th22:取各组外周血样本,1×106个细胞,1ml的细胞培养液重悬,每管加入2μl的刺激阻断合剂佛波酯(PMA,终浓度50ng/ml)和离子酶素(Ionomycin,终浓度2μg/ml),高尔基体阻断剂莫能菌素钠(Monensin sodium,终浓度3μg/ml),在37℃、5%CO2培养箱中共培养6h。洗涤后,加入2ml流式染色缓冲液洗涤1次,离心重悬细胞,每管加入5μl CD4抗体避光孵育;
每管加入固定剂1ml,重悬细胞避光孵育并离心后,每管加入破膜剂1ml,重悬细胞避光孵育,洗涤离心后,每管加入5μl的IL-17、IL-22抗体,4℃避光孵育45min。重悬细胞,上机检测。使用NovoCyte分析软件分析实验结果。
5.实时荧光定量聚合酶链反应:使用Trizol分离细胞总RNA,使用TaKaRa试剂盒反转录RNA形成cDNA。加入对应基因引物(表2),使用美国Bio-Rad公司荧光定量PCR仪进行实时PCR。使用比较性循环数(Ct法)测量基因的mRNA表达水平,以内参基因GAPDH表达为基准值,将目的基因表达值标准化为相对mRNA表达水平。

表2 PCR引物序列

1.HIF-1α在MM患者中的表达:MM患者的骨髓活检组织中,HIF-1α主要表达在间质组织中,少数在细胞质中(图1)。6例行骨髓活检的MM患者中,4例HIF-1α阳性率平均水平为12.00%±9.55%,1例为10%~20%,1例在30%以上,3例IDA患者骨髓活检组织中,HIF-1α阳性率平均水平均为5.31%±1.14%。在MM患者骨髓标本中,HIF-1α阳性率明显高于IDA患者(t=1.95,P=0.016)。

图1 免疫组化法检测骨髓活检组织中HIF-1α的表达(DAB染色,×200)A.多发性骨髓瘤患者;
B.缺铁性贫血患者
2.Treg、Th17和Th22占CD4+T细胞中的比例:
MM组患者与IDA组患者外周血中, Treg、Th17细胞占CD4+T细胞中的比例差异均无统计学意义(P=0.975,P=0.685),MM组患者外周血中,Th22占CD4+T细胞中的比例明显高于IDA组(P=0.037,图2)。MM组患者外周血中Th17/Treg比值明显高于IDA组(P=0.006,表3)。
表3 外周血中Th17、Treg和Th22占CD4+T细胞百分比

图2 流式细胞学检测外周血中Treg、Th17和Th22占CD4+T细胞百分比A.多发性骨髓瘤患者;
B.缺铁性贫血患者;
1.Th17;
2.Treg;
3.Th22
3.MM患者中T淋巴细胞耗竭相关基因表达:MM患者的T淋巴细胞中,NFATc1扩增水平明显高于IDA患者(P=0.019)。同时,IRF4、转录因子Helios、B淋巴细胞诱导成熟蛋白-1(B lymphocyte induced maturation protein-1,Blimp-1)、转录因子T-bet的扩增水平在MM组和IDA组患者之间比较,差异均无统计学意义(P>0.05,表4)。

表4 T淋巴细胞耗竭相关基因表达水平
4.Pearson相关性分析:Pearson相关性分析结果显示,在MM患者骨髓中,HIF-1α表达水平与Th17/Treg比值之间呈正相关,但差异无统计学意义(r=0.538,P=0.270,图3A),HIF-1α表达水平与Th22占CD4+T细胞百分比之间呈明显正相关(r=0.982,P=0.001,图3B)。Th17/Treg比值与MM患者的溶骨性病变之间呈正相关(r=0.879,P=0.009,图3C)。
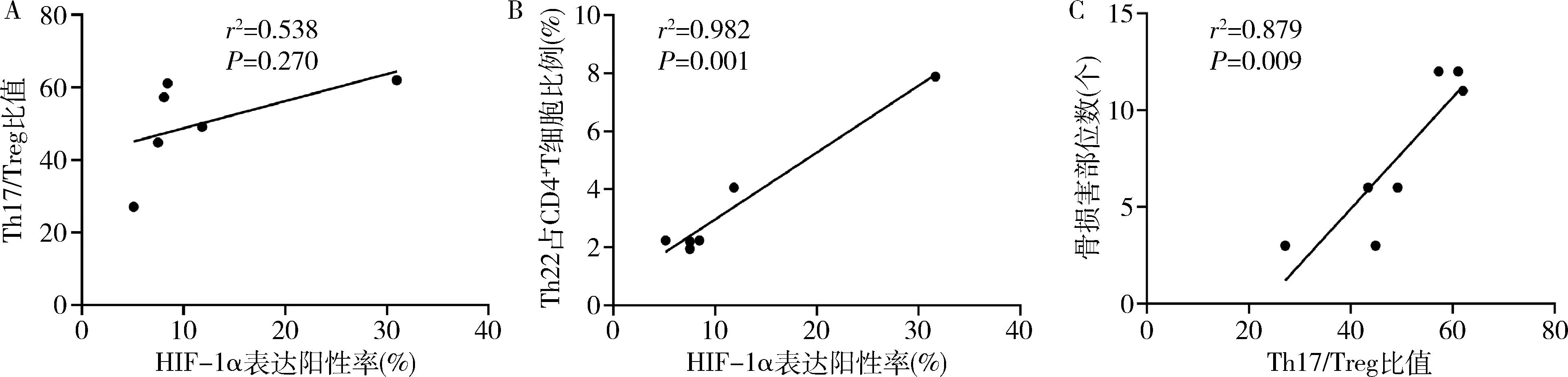
图3 HIF-1α与Th17/Treg比值、Th22以及Th17/Treg与骨损害的相关性分析A.HIF-1α与Th17/Treg比值;
B.HIF-1α与Th22;
C.Th17/Treg比值与骨损害
MM患者体内T细胞分化水平与健康人存在明显差异。部分研究表明,MM患者中Treg细胞分化增多,而Th17细胞分化减少,参与到意义未明的单克隆球蛋白病(monoclonal gammopathy of undetermined significance, MGUS)向MM进展的过程中[12]。另一部分学者研究表明,MM患者中Th17细胞、Th22分化及IL-17A、IL-22水平明显高于健康对照组,两者均能促进MM细胞增殖、黏附,与较差的疾病预后密切相关,其中Th17可通过诱导破骨细胞活性而促进溶骨性病变形成[5,6,13]。高水平的TGF-β,相对低水平的IL-6条件下,Foxp3占主导地位,推动T细胞从Treg/Th17向Treg倾斜。另一方面,低水平TGF-β,而高水平的IL-6激活STAT3,Foxp3对RORγt转录活性的抑制作用削弱,从而推动T淋巴细胞向Th17方向分化,因此Th17/Treg动态平衡是维持正常免疫功能的关键[14]。本研究发现,MM组患者外周血中Th17/Treg向Th17细胞分化方向倾斜,Th22细胞分化也明显高于IDA组,提示监测Th17/Treg和Th22可为发现疾病进展提供关键线索。
嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)具有单克隆抗体的抗原识别域和细胞内T淋巴细胞信号域,在结合特异性抗原后可直接发挥肿瘤杀伤作用,主要效应细胞为CD8+T细胞,靶向识别B淋巴细胞成熟抗原(B cell maturation antigen, BCMA)的CAR-T细胞在临床上已获得重大突破,维持CAR-T细胞的持续性的靶向杀伤活性是进一步改善治疗效果的关键[15]。然而,Tan等[16]研究发现,MM患者外周血和骨髓中耗竭表型T淋巴细胞,即表达PD-1、TIM-3的T淋巴细胞均显著增加,尤其在CD8+T细胞群中更为明显,而治疗后患者耗竭表型T淋巴细胞有所减少。肿瘤微环境中的髓源抑制性细胞(myeloid-derived suppressor cells, MDSC)可通过高表达PD-L1、CD80,分泌TGF-β和IL-10诱导T淋巴细胞耗竭[17]。慢性炎症环境下,转录因子IRF4、BATF和NFATc1激活也是T淋巴细胞耗竭的重要机制[7]。本研究发现,MM患者外周血T淋巴细胞中NFATc1表达水平较高,而其他耗竭相关基因IRF4、Helios、Blimp-1、T-bet水平无明显差异,还需要进一步扩大样本量,分析CD8+T细胞的抑制性表型,评估MM患者的T淋巴细胞耗竭程度。骨髓微环境中巨噬细胞的STAT3以及IL-17通过上调NFATc1表达,促进破骨细胞分化和增殖,破坏骨稳态[18,19]。MM患者T淋巴细胞中NFATc1的激活为进一步探究MM患者溶骨性病变机制提供思路。
在MM中,HIF-1α主要通过调节VEGF、BFGF、Ang-2等血管新生相关的因子,促进骨髓瘤血管新生而影响肿瘤生长[20]。炎症性疾病的相关研究表明,HIF-1α还可与缺氧反应元件结合,诱导下游转录因子激活,调节Th17和Th22细胞分化[8,9]。而关于MM中HIF-1α对免疫细胞的调节作用甚少研究。本研究结果提示,MM患者的骨髓活检组织中高表达HIF-1α,与Th17/Treg比值、Th22百分比呈一定的正相关,Th17/Treg和溶骨性病变程度呈明显正相关。HIF-1α可通过多种途径调节线粒体氧化能力、氧化磷酸化、生物发生、凋亡、裂变和自噬,而线粒体功能障碍是T淋巴细胞耗竭、衰老的元凶[21]。HIF-1α与T淋巴细胞线粒体功能障碍之间的关系和内在机制是下一步研究的方向。
综上所述,MM患者Th17/Treg、Th22水平升高,T淋巴细胞耗竭相关基因表达水平上调,表明MM患者的T淋巴细胞分化及功能状态异常;
骨髓中高表达的HIF-1α与异常的T淋巴细胞分化状态相关,HIF-1α调节T淋巴细胞分化和功能的内在机制的深入研究为提高MM CAR-T细胞疗效提供了新的可能性。

