钱石兵,张凌鹏,殷凌云,李昌全,李 虎,于鸿滨
(昆明市延安医院,昆明医科大学附属延安医院 口腔科,云南 昆明 650051)
临床中因为牙体牙髓、牙周等疾病导致的牙槽骨缺损已经屡见不鲜,这为后续的修复造成了严重的不便,进而影响患者的生理和心理健康[1]。尽管自体骨的移植疗效可能是更好的,但其对供区造成一定的创伤,一些骨替代材料开始运用于临床。其中Bio-Oss 无机小牛骨颗粒被普遍用于临床,得到国际的广泛认可[2]。Bio-Oss 骨粉具有超级多孔结构,有助于间充质干细胞(mesenchymal stem cell,MSC)爬行附着于骨粉表面分化形成新骨。牙髓干细胞(dental pulp stem cell,DPSC)是一类具有高度的分化能力的牙源性干细胞,如神经细胞、脂肪细胞、成骨和软骨细胞、血管细胞和牙本质细胞等[3,4]。多项研究证明Bio-Oss 骨粉与DPSC 具有良好的相容性、可行性和安全性,能够有效促进骨修复和愈合,显示出良好的应用前景[5−7]。但是鲜有文献提及Bio-Oss 骨粉与DPSC 的合适配比,若配比不合适,则会影响成骨的速度和效率。因此,本课题拟初步探究Bio-Oss 骨粉与DPSC 的大致配比,以期为临床应用提供有价值的信息。
1.1 主要仪器和试剂
0.25%胰蛋白酶(BI,以色列);
磷酸盐缓冲液(PBS,索莱宝);
α-MEM 培养基(Gibco,美国);
胎牛血清(BI,德国);
Human MSC Analysis Kit(BD,美国);
Human MesenCult™ Osteogenic Differentiation Kit(Stemcell,加拿大);
Human MesenCult™ Adipogenic Differentiation Kit(Stemcell,加拿大);
茜素红(索莱宝);
油红O(索莱宝);
酶联免疫检测仪(Thermo,美国);
流氏细胞仪(BD,美国);
碱性磷酸酶活性检测试剂盒(碧云天);
GFP 慢病毒(吉凯,中国)。
1.2 方法
1.2.1 DPSC 的分离、培养及鉴定经昆明医科大学附属延安医院伦理委员会审批通过,患者监护人签字同意,在口腔外科收集新鲜拔除、无牙体牙髓及牙周疾病且根尖未发育完全的第三磨牙。迅速用含2%双抗的α-MEM 培养基保存放入冰盒中,随即在细胞工作间中处理标本。用含2%双抗PBS 冲洗彻底清除血凝块并刮除根面软组织,使用咬骨钳将牙齿劈开,获取无损伤的牙髓组织,使用1 mL 注射器反复捣碎牙髓组织,转移至培养皿中倒置放入37 ℃细胞培养箱中温育15 min,加入含20% FBS 的培养基,动作轻柔勿使组织块浮起,每3 d 换液,待细胞大量爬出后消化细胞传代扩大培养。
流式细胞术鉴定:取第4 代DPSC 消化、离心,PBS 重悬,制备成单细胞悬液计数备用。以每管5×105个细胞数加入流式管内,根据试剂操作说明,加入CD11b、CD19、CD34、CD45、HLA-DR、CD73、CD90、CD105 抗体,避光孵育30 min。加入鞘液清洗1 遍,弃上清,然后加入200~300 µL 的鞘液上机,检测细胞表面抗原,进行免疫表型分析。
1.2.2 DPSC 成骨、成脂向分化取第4 代DPSC,每孔5×105个细胞接种于6 孔板内,待细胞融合在 80%以上时更换 Human MesenCult™Osteogenic Differentiation Kit 和Human MesenCult™ Adipogenic Differentiation Kit,对照组正常培养,连续培养3 周后吸弃培养基并用PBS漂洗,加入70%乙醇固定细胞2 h,PBS 洗3 遍,加入茜素红和油红O 染色5 min,倒置显微镜下观察染色的面积大小以及颜色深浅。
1.2.3 GFP 病毒转染DPSC根据吉凯病毒转染手册,预实验摸得GFP 病毒转染DPSC 的MOI=10。取24 孔板,每孔接种4×104个细胞,细胞融合至90%左右加入嘌呤霉素,设置0.25 µg/L、0.5 µg/L、1 µg/L、1.5 µg/L、2 µg/L 浓度,摸得48 h杀死全部细胞的最低浓度为0.5 µg/L。取第3 代DPSC 和6 孔板,每孔接种5×105个细胞,计算并加入相应的慢病毒体积,转染96 h 后换液,加入0.5 µg/L 嘌呤霉素培养基,杀死野生型细胞。
1.2.4 碱性磷酸酶(Alkaline phosphatase,ALP)活性检测取24 孔板,每孔加0.05 g 骨粉铺满孔板底,成骨培养基浸润骨粉后,分别加入1×105、2×105、4×105、8×105个细胞,对照组不加骨粉,其余条件一致培养。分别在培养第3 天和第7 天时用1%×-Trition 裂解细胞,4 ℃下,14000 g离心3 min 后取上清,按照碧云天碱性磷酸酶试剂盒操作说明测定ALP 活性。
1.2.5 SEM 扫描DPSC 在骨粉表面黏附的情况按照同上条件,Bio-Oss 和DPSC 复合培养7 d 后,小心吸弃培养液,每孔加入1 mL 赛维尔扫描电镜固定液,4 ℃ 固定细胞4 h 后送至赛维尔生物公司进行扫描电镜。
1.3 统计学处理
2.1 DPSC 的培养及多向分化能力鉴定
牙髓组织采用组织块法贴壁培养5 d 后镜下可见类成纤维样的细胞沿着组织块边缘呈放射状爬出(图1A),传代后细胞生长速度加快(图1B)。对照组则无红色的颗粒(图1C)。细胞连续诱导成骨3 周后茜素红染色后可见大量明显红色的颗粒(图1D),对照组则未见染红的脂滴(图1E),细胞向成脂诱导3 周后油红O 染色后可见有脂滴被染红(图1F)。表明DPSC 具有多向分化潜能,属于间充质干细胞来源。
2.2 DPSC 表面标记物的检测
流式细胞术检测显示间充质干细胞表面标志物CD73 占99.90%,CD90 占99.96%、CD105 占99.08%,均呈阳性高表达,而造血细胞标记物CD34、CD45 以及免疫细胞表面标记物CD19、CD11b、HLA-DR 则呈阴性(占0.12%),证明属于间充质干细胞家族,排除造血来源的干细胞(图2)。

图2 流式鉴定DPSC 干细胞标记物Fig.2 Identification of DPSC surface antigen by flow cytometry
2.3 GFP 病毒转染DPSC 以及DPSC 在骨粉中的生长形态
在转染GFP 后,48 h 后荧光显微镜下可见散在少量的荧光表达,在96 h 达到高峰(图3A~3C)。GFP-DPSC 在Bio-Oss 骨粉中可以很好的生长和增殖,随着培养时间的延长,细胞逐渐爬行至骨粉的深部孔隙之中(图4A~4B)。

图3 GFP 转染DPSC 不同时间荧光表达(×100)Fig.3 Fluorescence expression of GFP transfected DPSC at different time
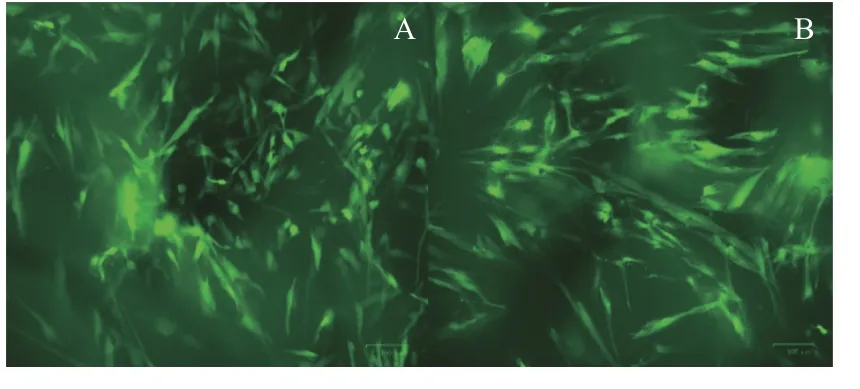
图4 GFP-DPSC 在Bio-Oss 骨粉中的生长(×100)Fig.4 Growth of GFP-DPSC in Bio-Oss bone powder
2.4 不同浓度DPSC 成骨分化ALP 活性比较
第3 天和第7 天与对照组相比,DPSC 复合骨粉培养后ALP 活性比对照组高,P<0.05,差异具有统计学意义,说明不同数目的DPSC 复合同样质量的Bio-Oss 骨粉的成骨能力是不一致的。第3 天时,各组ALP 活性呈指数型曲线,但到第7 天时,4×105和8×105组的ALP 活性并没有与第3 天时的保持一致,细胞数目翻倍,但8×105组的ALP 活性并没有翻倍,出现了下降的趋势(图5 和图6)。
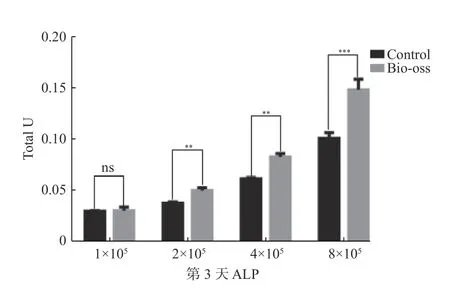
图5 第3 天ALP 活性比较Fig.5 Comparison of ALP activity on day 3
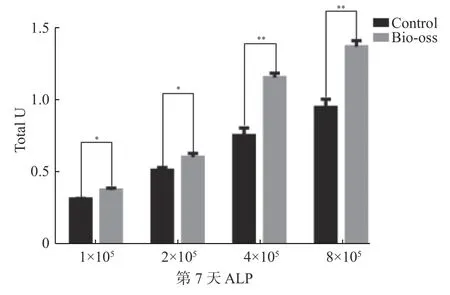
图6 第14 天ALP 活性比较Fig.6 Comparison of ALP activity on day 14
2.5 SEM 扫描结果
SEM 扫描图片发现1×105(图7)和2×105(图8)组黏附爬行在骨粉表面的细胞数目较少,4×105(图9)组细胞数目稍多,8×105(图10)组爬满整个骨粉表面,部分细胞呈复层生长。细胞在骨粉表面爬行黏附后会伸出伪足与骨粉表面进行连接(图7~10)。

图7 1×105 组同一视野下SEM 图像Fig.7 SEM images of 1×105 groups in the same field of view

图8 2×105 组同一视野下SEM 图像Fig.8 SEM images of 2×105 groups in the same field of view

图9 4×105 组同一视野下SEM 图像Fig.9 SEM images of 4×105 groups in the same field of view

图10 8×105 组同一视野下SEM 图像Fig.10 SEM images of 8×105 groups in the same field of view
众所周知,支架和干细胞是再生工程的两个关键要素,Bio-Oss 骨粉已经被广泛用于口腔牙槽骨缺损的患者,其临床疗效已经得到认可,能够有效形成新骨,修复骨缺损[7−9]。Bio-Oss 骨粉作为一种替代的生物材料,具有高柔韧性和可塑性以及最少的感染和免疫反应风险[10,11]。Bio-Oss 骨粉可以为多种MSC 的存活提供良好的环境,MSC 能够附着在Bio-Oss 支架上增殖和分化[12]。在动物研究中,植入Bio-Oss 骨粉的MSC 增加了支架与宿主骨的整合,并将其形态改变为成骨样细胞[13]。在体外循环压缩压力下,在循环压缩压力下,骨髓间充质干细胞(Bone marrow mesenchymal stem cell,BMSC)向成骨细胞的分化显著增加[14]。在上颌窦底提升过程中,植入BMSC 和Bio-Oss 的加压复合物可促进新骨的形成[15]。在脂肪来源的干细胞(adipose-derived stem cell,ADSC)和Bio-Oss 的复合物局部注射信号素3A(Sema3A)促进了2 型糖尿病的大鼠颅骨骨再生[16]
尽管Bio-Oss 骨粉与MSC 能够更好的促进成骨,但是很多实验并未明确指出MSC 的接种数目和合适的Bio-Oss 质量。而且,笔者认为固定质量的Bio-Oss 骨粉所能容纳的干细胞数目是有限的,如果干细胞数目过少,则无法充满骨粉的孔隙,成骨的效率减弱;
若干细胞数目过多,则会造成竞争,造成干细胞资源的浪费。另一方面,干细胞的种类也同样影响接种数目,因为不同的干细胞其大小、增殖能力和分化能力是不一致的[17,18]。ADSC、BMSC 和DPSC 都具有形成矿化组织的能力。然而,对于其矿化组织工程能力的比较研究较少,未得到充分的探索。研究发现,DPSC 的成骨潜能明显大于BMSC 和ADSC,DPSC 具有产生相对高量矿化基质的最大潜力[19]。将BMSC 和DPSC 联合Bio-Oss 移植在颅面区域促进骨再生,发现2 组具有相似的骨密度、新骨形成和成骨相关蛋白表达,在体内的骨再生效果相匹配[20]。一项meta 分析评价显示,与对照组相比,在4 周时,DPSC 与支架复合物的新骨形成显著增加[21]。但是在阅读文献时发现没有明确的细胞和骨粉用量,作者是否认为这不是一个重要的信息所以没有描述。如Wang 等[22]仅描述以2 × 106细胞/mL 的密度将BMSCs 悬液加入Bio-Oss 颗粒中,未说明骨粉具体质量,但是DPSC与BMSC 的细胞形态大小以及分化能力是不一致的,所以BMSC 接种的数目对DPSC 而言并没有太多的指导价值。
Bio-Oss 骨粉作为固体颗粒具有遮光性,普通光镜下无法看到细胞的状态,因此本课题预先将GFP 慢病毒成功转染DPSC 并筛选扩大培养以便于在荧光显微镜下观察。笔者发现大约0.05g的骨粉可以均匀散在的铺在24 孔板的底部,将细胞数目定为1×105、2×105、4×105、8×105四组。ALP 是成骨分化过程中细胞分泌的的一种酶,它的表达活性是成骨细胞分化、成熟一个非常明显的特征[23]。在第3 天时,ALP 活性测定的数值发现8×105组几乎是4×105的两倍,与细胞数目增长的趋势大致相同。但是在第7 天时,4×105但8×105组却没有出现预期的结果,与第3 天的结果保持一致,反而稍稍出现了一个降低的趋势,说明随着培养时间的延长,细胞数目增殖过多,抑制了成骨分化的效率。隔天在荧光显微镜下监测GFP-DPSC 在Bio-Oss 骨粉中的生长状态,发现着培养时间的延长,细胞形态发生了变化,部分逐渐变成了不规则的形状,不再是长梭形的类成纤维细胞样形态。Bio-Oss 骨粉之间的孔隙并非完全规则的,并且骨粉作为一种刚性物质,干细胞需要做出改变以适应这样的结构,而且Bio-Oss 骨粉没有细胞毒性,并不会影响干细胞的增殖[24]。通过扫描电镜发现,1×105、2×105两组细胞较为散在的附着在骨粉表面,4×105组细胞比较密集的附着在骨粉表面,而8×105组则看见细胞堆叠生长。通过放大电镜下观察倍数发现,细胞表面可伸出部分伪足附着于骨粉之上,形成更为紧密的连接。
干细胞成骨分化是一个周期较长的过程,细胞逐渐爬行到骨粉更深的内部结构之中,骨粉作为一个立体的物质,荧光显微镜下可以在不同层面观察到细胞,但是这也为笔者无法全面观察细胞带了一定的影响。在实验过程中笔者发现GFPDPSC 和Bio-Oss 骨粉复合物培养时间到成骨中后期,GFP 的荧光强度逐渐减弱,这是由于干细胞分化过程中已经不再是干细胞,而是逐渐变为成骨细胞[25]。另一方面,细胞在诱导分化过程中仍在增殖,因此笔者尝试连续在成骨培养基中诱导21 d 后用DAPI 染色,在蓝色荧光下根据细胞核显色的数目大致估计培养21 d 后的细胞数目。由于Bio-Oss 骨粉均能被蓝色荧光和绿色荧光激发成像,而且在不同层面均能观察到细胞,这对实验结果造成了干扰。尽管结果不理想,但仍旧可以作为一个参考,4×105、8×105两组的细胞可以在镜下看到密集的蓝色的细胞核。
通过以上实验结果,笔者认为0.05 g Bio-Oss 骨粉接种4×105~8×105个细胞是一个合适的密度范围,细胞在骨粉中爬行生长需要一定的时间,而且干细胞具有强大的增殖能力,若开始时细胞接种数目过多,则会对细胞的生长和增殖造成抑制,反而影响成骨效率。根据现有的实验结果,未来还需进行免疫组化和Micro-CT 精细扫描获得更精确的结果完善实验完整性。
猜你喜欢骨粉成骨数目经典Wnt信号通路与牙周膜干细胞成骨分化口腔医学(2021年10期)2021-12-02移火柴小猕猴智力画刊(2021年6期)2021-08-05骨粉加工技术农家之友(2019年5期)2019-01-17微粉碎骨粉对火腿肠食用品质的影响成都大学学报(自然科学版)(2017年2期)2017-07-06糖尿病大鼠Nfic与成骨相关基因表达的研究中华老年口腔医学杂志(2016年2期)2017-01-15PRF联合珊瑚骨粉在前牙美学区拔牙位点保存的临床研究西南国防医药(2016年6期)2016-12-01《哲对宁诺尔》方剂数目统计研究中国民族医药杂志(2016年5期)2016-05-09牧场里的马作文大王·低年级(2016年3期)2016-03-11液晶/聚氨酯复合基底影响rBMSCs成骨分化的研究中国病理生理杂志(2015年8期)2015-12-2130例Ⅰ型成骨不全患者股骨干骨折术后康复护理天津护理(2015年4期)2015-11-10
